安全・安心
考え方・方針
宝グループは、食品や医療に関わる企業として、お客様に安心を感じて頂くことが重要であると考えています。将来にわたってお客様に信頼される企業グループであり続けるために、「宝グループ品質方針」を定め、取り組みを進めています。
宝グループ品質方針
私たちは、「自然との調和を大切に、発酵やバイオの技術を通じて人間の健康的な暮らしと生き生きとした社会づくりに貢献します。」という宝グループの企業理念のもと、安全で安心していただける商品・サービスを世界中のお客様にお届けします。
- 1.私たちは、お客様の声に真摯に耳を傾け、ご満足頂ける品質を追求します。
- 2.私たちは、お客様に商品をお届けするまでの全てのプロセスにおいて、グループ一体となって品質保証活動に取り組みます。
- 3.私たちは、関連する法令・自主基準を遵守します。
- 4.私たちは、適切でわかり易い情報提供に努め、お客様の信頼にお応えします。
目標
| 取り組みテーマ | 具体的施策 | 目標 |
|---|---|---|
| 宝酒造における安全・安心な品質の確保 | 食品安全マネジメントシステム(FSSC22000 国内自社工場6拠点)の維持 |
【宝酒造】 ・自社工場全6拠点*のFSSC22000を維持する。 (*松戸工場、楠工場、伏見工場、白壁蔵、黒壁蔵、島原工場) |
|
宝酒造の安全な商品づくり ・設計段階における関連法令・自主基準への適合性審査 ・安全性を確認した原料の安定調達 ・安全かつ安定した品質を作り込む製造ラインの維持・向上 |
【宝酒造】 ・商品設計、原料調達、製造の各段階における安全品質の確認を徹底し、品質管理体制をいっそう強化させる。 ・新規委託先及び新規原料サプライヤーへの監査と品質管理評価の実施率100%を維持する。 ・品質保証書による原材料の安全性確認100%を維持する。 |
|
| お客様満足の追求(ISO10002) |
【宝酒造】 苦情対応プロセス及び対応部門の知識を向上させる。 a)お客様相談室スタッフの知識向上に向け、品質管理部門による講習を年1回以上行う。 b)お客様訪問時における対応品質向上に向け、訪問時マニュアルに対する理解度テストを実施する。(テスト実施率100%達成) |
|
| タカラバイオグループにおける安全・安心な品質の確保 | タカラバイオグループの品質マネジメントシステム(ISO9001ほか)の維持 |
【タカラバイオグループ】 ・すでにISO認証を取得した事業所におけるISO認証を維持し、品質向上及び顧客満足度の向上に努める。必要に応じて、ISO認証取得範囲の拡大に努める。 ・事業に必要な業許可・登録等を維持する。 |
| GMP/GCTP(※1)等の各種品質・製造・安全基準、第三者認証制度への適合・維持 | ||
| 製品情報の適切な開示 |
【タカラバイオグループ】 自社製品(試薬)に関し、2025年度までに、SDS(セーフティー・データ・シート※2)を多様な言語(日、英、中)で情報提供を行う。 |
|
| 宝酒造インターナショナルグループにおける安全・安心な品質の確保 |
グローバルな品質保証体制構築に向けた取り組み ・海外の食品安全法規情報の把握と遵守 ・主な海外グループ会社の食品安全に関する認証取得推進 |
【宝酒造インターナショナルグループ】 ・輸出対象国の食品法規適合率100%を継続する。 ・2025年度までに海外グループ会社への品質監査を実施し、品質リスクとなる要素が発見された場合は適切に是正する。 |
- ※1 GMP:Good Manufacturing Practice、 GCTP:Good Gene, Cellular, and Tissue-based Products Manufacturing Practice
- ※2 SDS: Safety Data Sheet(化学物質等安全データシート)
関連するSDGs
取り組み
宝酒造における安全・安心な品質の確保
食品安全マネジメントシステム(FSSC22000 国内全6工場)の維持
宝酒造では、国内全6工場(松戸工場、楠工場、伏見工場、白壁蔵、黒壁蔵、島原工場)において、国際的な食品安全マネジメントシステムである「FSSC 22000」を導入し、製品の安全性と品質の確保に取組んでいます。
宝酒造の安全な商品づくり
設計段階における関連法令・自主基準への適合性審査
商品の設計プロセスにおいては、原料・包装資材から製造工程、商品表示、出荷に至る全ての設計内容に対してデザインレビュー手法を実施し、品質・安全性・機能性・法規制適合性の確保に努めています。 また、商品設計及び開発に携わるスタッフの関連法規の知識レベル向上を目的とし、スタッフ向けに酒類業組合法、食品表示法、景品表示法などの関連法規、食品表示などの勉強会を定期的に実施しています。
-
安全性を確認した原料の安定調達
原料の調達においては、調達ルートがすべて間違いなく確認できたもので、品質保証書において品質・安全性・適法性が確認できた原料のみを採用しています。これらの取り組みに加え、原料を供給するサプライヤーへの定期的な品質監査や、原料や調達先の状況に応じて、残留農薬や重金属などの分析を行い、有害物質の混入がないことを確認し、原料品質の信頼性を高めています。
-

分析装置を利用した成分分析・検査
安全かつ安定した品質を作り込む製造ラインの維持・向上
工場の製造ラインでは、新規技術を取り入れ、徹底した設備保全管理と製造工程管理を行い、高い品質を確保しています。また、検査機による外観や異物、印字などの全数検査を実施し、さらに検査部門では、専門パネリストによる官能検査や最新の分析装置による成分分析・検査を行っています。中期経営計画2025では143億円を投資し、安全で安心できる製品づくりに努めていきます。
-
「缶入りチューハイ製品の自主回収」を受けて強化した取り組み
2021年5月の缶入りチューハイ製品の自主回収は宝酒造自社工場の製品生産設備の保全不足、検査体制の不備により発生しましたが、二度と発生させないよう、全社的な安全・安心の管理組織として、2022年度より「安全・安心推進室」を新たに設置し、品質管理、品質改善の推進強化に努めています。再発防止対策の主な取り組みの一つ目として、過去の事例に基づき、改めて品質リスクの抽出を行い、必要な改善を行いました。二つ目の取り組みとして、製品全数を対象とした自動検査機を導入しました。三つ目の取り組みとして、設備の新設・更新時のみならず、定期点検に合わせて、最新の技術・機能を追加し、継続的な改善を図っています。
-

導入した検査機
-
食品衛生優良施設 厚生労働大臣表彰の受賞
宝酒造株式会社 「伏見工場(西)」及び「白壁蔵」は、厚生労働省と公益社団法人日本食品衛生協会が主催する令和7年度「食品衛生功労者・食品衛生優良施設表彰」において、優良な食品衛生施設について他の模範とすることを目的とした「食品衛生優良施設」として表彰されました。
両工場はこれまでFSSC22000の認証を継続して取得し、食品安全および品質管理のマネジメントシステムを適正に運用している点など、生産管理体制が良好であることが評価され受賞に至りました。 -

表彰式
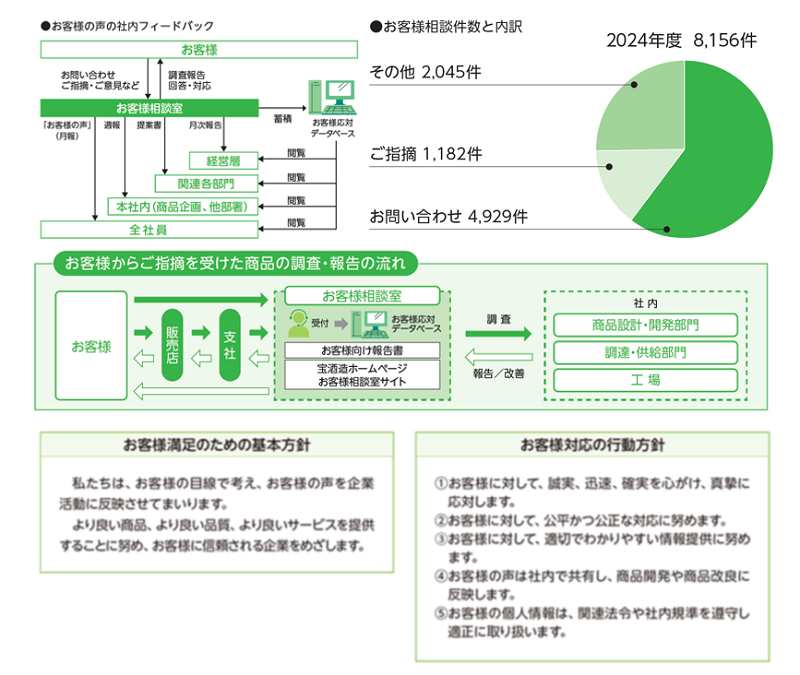
お客様満足の追求(ISO10002)
お客様相談室には、2024年度8,156件のお客様の声をいただいております。商品に関するお問い合わせやご意見ご指摘など、多岐にわたりますが、これらの一つひとつに真摯に耳を傾け、ご満足いただける商品づくりやサービスの向上に取り組んでいます。また、よくいただくお問い合わせについて、お客様相談室ホームページに動画を掲載して、さらにお客様が分かりやすいように取り組みを進めています。
お客様対応/苦情対応マネジメントシステム(ISO10002)の自己適合宣言により、お客様応対の向上に向けた具体的な取り組みや責務を明確にすることで、お客様対応プロセスの継続的な改善に取り組んでいます。
宝酒造インターナショナルグループにおける安全・安心な品質の確保
グローバルな品質保証体制構築に向けた取り組み
宝酒造インターナショナルでは、海外品質保証・品質管理担当を設置し、さらなる品質保証体制の強化を図っています。定期的に開催している海外グループ会社の経営層との会議においては、品質方針の共有化や食品安全に関する情報の交換・収集に取り組んでいます。また、宝ホールディングスグループ品質保証室と連携して、海外グループ会社の品質監査を実施することで、品質リスクの洗い出しと工程改善を行い、より安全・安心な品質の確保に努めています。
タカラバイオグループにおける安全・安心な品質の確保
タカラバイオグループの品質マネジメントシステム(ISO9001ほか)の維持
タカラバイオグループでは、タカラバイオ、宝生物工程(大連)有限公司、タカラバイオDSSインド、タカラバイオヨーロッパS.A.Sにおいて、品質マネジメントシステムISO9001の認証を取得しています。あわせて、タカラバイオUSAと宝生物工程(大連)有限公司においては、診断薬などの品質マネジメントシステムISO13485の認証を取得し、厳正な品質管理を行っています。さらに、タカラバイオにおいては衛生検査所登録、CAP-LAP(米国病理学会の臨床検査室認定)、特定細胞加工物製造業などの第三者認証や許可を取得し、製品やサービスの継続的な品質向上に取り組んでいます。
GMP/GCTP※等の各種品質・製造・安全基準、第三者認証制度への適合・維持
タカラバイオでは、再生医療等製品の開発製造支援を行なうCDMO事業や自社の遺伝子治療プロジェクトの臨床試験で使用する治験製品の製造を行う、遺伝子・細胞プロセッシングセンターにおいて、GMP/GCTPに準拠した業務を行うとともに、衛生検査所登録、特定細胞加工物製造業、再生医療等製品製造業などの業許可を取得しています。また、CAP-LAP(米国病理学会の臨床検査室認定)などの第三者による認証を取得するなどの取り組みを行っています。
- ※医薬品や再生医療等製品の製造・品質管理基準
製品情報の適切な公開
製品の安全性に関する資料を積極的に公開しています。製品説明書、CoA(分析証明書)、SDS(化学物質等安全データシート)、毒物及び劇物取締法に基づく毒劇物の表示、カルタヘナ法に基づくLMO(遺伝子組換え生物)該当品など、法令や規制に基づいた適切な情報の公開・提供を多様な言語で行っています。



